원자는 전체적으로 어떤 전하를 띠고있나요
“원자는 전체적으로 무슨 전하를 띠고 있나요?”라는 질문은 학생들이 과학 시간에 가장 자주 궁금해하는 내용 중 하나입니다. 결론부터 말씀드리면, 원자는 전체적으로 전기적으로 중성입니다.

💡 원자의 구조 간단 요약
원자는 크게 두 부분으로 구성되어 있습니다:
- 원자핵: 양성자(+)와 중성자(0)가 있음
- 전자 구름: 전자(-)가 원자핵 주변을 돌고 있음
🔋 전하의 구성 요소
| 입자 | 전하 | 위치 |
|---|---|---|
| 양성자 | + | 원자핵 |
| 전자 | - | 원자핵 주위 |
| 중성자 | 0 | 원자핵 |
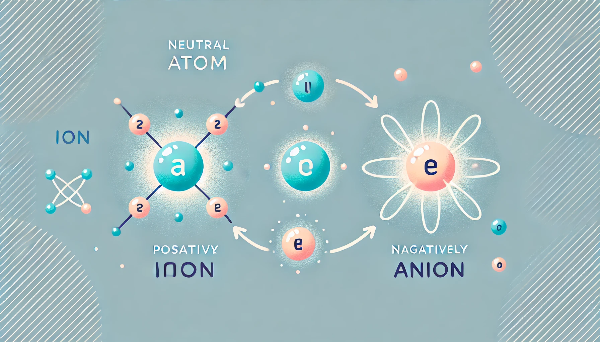
원자가 중성인 이유는?
양성자의 개수 = 전자의 개수이기 때문입니다. 각각의 전하가 상쇄되기 때문에 원자 전체는 전기적으로 중성이 됩니다.
예를 들어 수소 원자는 양성자 1개와 전자 1개로 구성되어 있어, +1과 -1이 합쳐져 0이 됩니다. 따라서 전하가 없습니다.
예외 상황도 있을까?
네, 이온 상태에서는 전자 수가 달라져 전체 전하가 변할 수 있습니다.
- 양이온: 전자를 잃어 + 전하를 가짐
- 음이온: 전자를 얻어 - 전하를 가짐

FAQ: 원자의 전하 관련 Q&A
Q. 원자는 왜 전기적으로 중성인가요?
양성자 수와 전자 수가 같기 때문에, 서로의 전하가 상쇄되어 전기적으로 중성이 됩니다.
Q. 전자 수가 더 많거나 적어지면 어떻게 되나요?
그럴 경우 이온이 됩니다. 전자를 잃으면 양이온(+), 전자를 얻으면 음이온(-)이 됩니다.
Q. 중성자는 전하에 영향을 주나요?
아니요. 중성자는 전기적 전하가 없기 때문에 전하에는 영향을 주지 않습니다.
🔍 마무리 요약
원자는 전기적으로 중성입니다. 양성자와 전자의 수가 같기 때문이죠. 하지만 전자의 개수가 변하면 이온이 되어 전하를 띨 수 있습니다. 과학의 기본이 되는 개념이니 꼭 기억해두세요!
📚 더 자세한 원자 구조는 한국과학창의재단에서 확인하실 수 있습니다.
'교육' 카테고리의 다른 글
| 태양계 행성 탐사에 필요한 물건 총정리 (수금지화목토천해) (0) | 2025.03.27 |
|---|---|
| 내신 7~9등급, 대학 갈지말지 당신을 위한 현실적인 진학 전략 (2) | 2025.03.26 |
| 자퇴한 학교에 다시 다닐 수 있을까? 고등학교 재입학의 모든 것 (0) | 2025.03.26 |
| 경영학과 vs 국어교육과, 진로 선택 전 반드시 알아야 할 현실적인 비교 (2) | 2025.03.25 |
| 입시미술학원 가격과 미대 준비 비용 총정리 (2025 기준) (1) | 2025.03.24 |



